Innovationen für die Pathohistochemie
Auf dem Gebiet der Histologie besitzt EUROIMMUN eine einzigartige Kompetenz. So befasst sich der Geschäftsbereich Immunfluoreszenz des Unternehmens mit der serologischen Diagnostik von Autoantikörpern und verwendet dazu Gewebeschnitte, auf deren vollautomatische Handhabung er spezialisiert ist. Die entsprechenden Reagenzien sind weltweit im Einsatz, ihr Anteil am Gesamterlös der Firma (240 Millionen EURO im Jahr 2016) liegt bei etwa einem Drittel.
Im Vergleich dazu wird in der Pathohistochemie, einem neuen Schwerpunkt der Firma EUROIMMUN, nicht das Serum mittels Gewebeschnitten untersucht, sondern es geht um das Gewebe selbst: Die Beschaffenheit histologischer Proben und ihre Reaktivität mit definierten Antikörpern oder anderen Reagenzien werden analysiert und mikroskopisch ausgewertet.
Mit der Beherrschung der EUROTide-Inkubationstechnik und der BIOCHIP-Technologie sind wir prädestiniert, auch die Pathohistochemie zu modernisieren – oder deutlicher gesagt: zu revolutionieren. Beide sind Alleinstellungsmerkmale von EUROIMMUN. Sie werden durch ein Arsenal an Neuentwicklungen ergänzt. Wir wollen auf diesem Gebiet weltweit zum Marktführer aufsteigen, wie es uns in der Autoimmundiagnostik längst gelungen ist.
EUROPath stützt sich auf mehrere bewährte Erfindungen, an denen Mitarbeiter der Firma EUROIMMUN maßgeblich beteiligt waren: TITERPLANE-Technik, MERGITE!, EUROTide, die BIOCHIP-Technologie, die chemische Aktivierung der Objektträger-Oberfläche und computergestätzte Immunfluoreszenz-Mikroskopie (CAIFM). Außerdem kommen bei EUROPath mehrere neue Strategien zum Einsatz, darunter die vollautomatische Färbeplattform EP-Dx, die rekombinante Darstellung von Substraten zur Funktionskontrolle der Reagenzien, die EUROPath-Mikroskopie und EUROPathOffice als Spezialisierung des im serologischen Labor etablierten EUROLabOffice, die Kryptocodierung fur BIOCHIP-Glasfolien, Laser-Perforation von Objektträgern (Sollbruchstelle), das Eindecken unter Verwendung Kunstharz-vorbeschichteter Deckgläser oder mittels bei EUROIMMUN etablierter Verfahren der BIOCHIP-Bestückung.
STAND DER HISTOCHEMISCHEN TECHNIK BEI EUROIMMUN
Die erste zum Patent angemeldete Erfindung des Gründers der Firma EUROIMMUN war die TITERPLANE-Technik, bei der zwischen zwei flachen Analyseplatten histochemische oder andere Reaktionen ablaufen und die flüssigen Proben oder Reagenzien von sich gegenüberliegenden hydrophilen Reaktionsfeldern festgehalten werden: Proben oder Reagenzien werden auf
Reagenzträger pipettiert. Dann werden Objektträger mit Gewebeschnitten oder Kulturzellen von oben in Aussparungen der Reagenzträger gelegt, sodass die Substrate, die den Feldern des Reagenzträgers kongruent gegenüber liegen, mit den Tropfen in Kontakt kommen. Die Proben verlaufen nicht, eine „feuchte Kammer“ ist überflüssig. Dass die Reaktionen simultan starten, trägt zur Standardisierung der Analytik bei (1).
MERGITE! (Taucht ein!, 22) vollendet das bei TITERPLANE eingeschlagene Konzept. Die kopfüber inkubierten Objektträger werden beim Waschen nicht umgedreht, sondern, mit den Reaktionsfeldern nach unten, in ein Waschmodul. Dieses weist stalagmitenartige Säulen auf, deren plane Oberflächen den Reaktionsfeldern im Abstand von einem Drittel Millimeter gegenüberliegen. Aus der Säulenmitte quillt mit niedriger Fließrate phosphatgepufferte Kochsalzlösung, strömt laminar an den Substraten vorbei nach außen und rinnt an jeder Säule abwärts, ohne dass sich die Flüssigkeit benachbarter Proben im Reaktionsbereich miteinander vermischt. Es reichen 15 Sekunden für einen Waschschritt! Und die Oberfläche der Objektträger bleibt außerhalb der Reaktionsfelder trocken. Bechergläser, Küvetten und kilometerweise Papierhandtücher haben ausgedient! MERGITE! lässt sich auch in einen vollautomatischen Arbeitsablauf integrieren – damit hat die die Immunhistochemie ihre letzte Hürde genommen, jetzt kann sie den vielen anderen immunbiochemischen Analyseverfahren Paroli bieten.
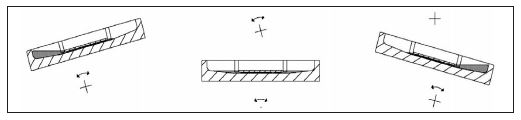
EUROTide ist eine Weiterentwicklung der TITERPLANE-Technik: Festphasensubstrate warden auf länglichen Adhäsionsflächen eines Objektträgers angeordnet und von oben in Kontakt mit den Flüssigkeiten gebracht, die sich in – den Adhäsionsflächen genau gegenüberliegenden – flachen Rinnen eines Reagenzträgers befinden.
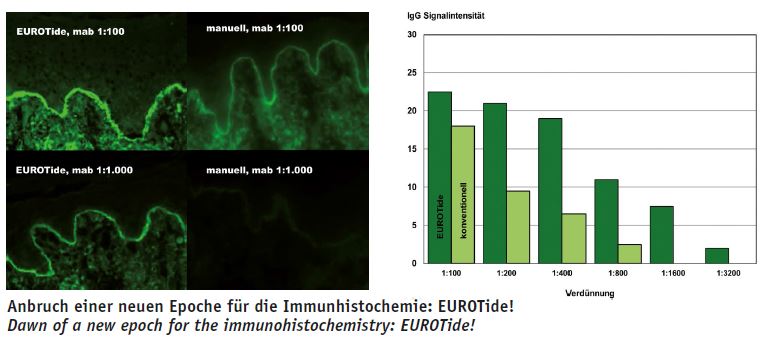
 Während der Inkubation wird die Anordnung ständig einer langsamen rhythmischen Kipp-Bewegung ausgesetzt und dadurch eine kräftige Konvektion in der Flüssigkeit erzwungen, was zu einer äußerst effektiven Durchmischung der Reaktanden führt (13). Diffusionsgradienten werden permanent abgebaut und die Reaktionen laufen schneller ab und werden stärker. Ein Farbkristall braucht ohne Bewegung der Flüssigkeit mehrere Stunden, um sich aufzulösen, mit EUROTide nur wenige Sekunden. In der Autoimmundiagnostik warden mit EUROTide zehnmal höhere Titer als mit konventioneller Inkubation erzielt (28). Die Reaktionen erscheinen über die gesamte Fläche jedes Substrats einheitlich und gleichmäßig. Werden mehrere Proben separat nebeneinander untersucht, verhindert die Anordnung, dass sich die Flüssigkeiten benachbarter Proben während der Inkubation untereinander vermischen.
Während der Inkubation wird die Anordnung ständig einer langsamen rhythmischen Kipp-Bewegung ausgesetzt und dadurch eine kräftige Konvektion in der Flüssigkeit erzwungen, was zu einer äußerst effektiven Durchmischung der Reaktanden führt (13). Diffusionsgradienten werden permanent abgebaut und die Reaktionen laufen schneller ab und werden stärker. Ein Farbkristall braucht ohne Bewegung der Flüssigkeit mehrere Stunden, um sich aufzulösen, mit EUROTide nur wenige Sekunden. In der Autoimmundiagnostik warden mit EUROTide zehnmal höhere Titer als mit konventioneller Inkubation erzielt (28). Die Reaktionen erscheinen über die gesamte Fläche jedes Substrats einheitlich und gleichmäßig. Werden mehrere Proben separat nebeneinander untersucht, verhindert die Anordnung, dass sich die Flüssigkeiten benachbarter Proben während der Inkubation untereinander vermischen.
Dass bei TITERPLANE, EUROTide und MERGITE! die Gewebeschnitte von oben in die flüssigen Proben oder Reagenzien eintauchen, kommt der Analysequalität zugute:
- Reagenzien oder Patientenseren sind häufig mit Kristallen, Bakterien und Schmutzpartikeln verunreinigt. Diese fallen während der Inkubation bei herkömmlicher Technik nach unten in die Gewebeschnitte, lassen sich nicht gänzlich herauswaschen und stören das mikroskopische Bild. Von der Autoimmundiagnostik kennen wir dieses Problem genau: Will man anständige Fotos ohne lästigen Hintergrund präsentieren, müssen die Gewebeschnitte bei der Inkubation von oben in die Tropfen tauchen. Am Ende hat man klare Bilder und eindeutige Ergebnisse.
- Die Gewebeschnitte bleiben während der Inkubationen und der Waschprozeduren ohne Unterbrechung von Flüssigkeit umgeben. Dadurch werden Störeffekte vermieden, wie sie bei herkömmlicher Inkubation durch Trocknungsprozesse gelegentlich vorkommen: Die Salzkonzentration in der Restflüssigkeit steigt an – teilweise extrem – und die Zellen oder das Gewebe werden osmotisch ausgelaugt, sodass ihr Inhalt teilweise an die Umgebung abgegeben wird. Oder es bilden sich Salzkristalle, die die Morphologie beeinträchtigen.
- Schließlich kann es passieren, dass das Gewebe bei herkömmlicher Inkubation durch Oberflächenspannung gequetscht wird oder sich störende Partikel auflagern, wenn sich die Oberfläche der Flüssigkeit ins Gewebe absenkt. Etwas Ähnliches kann man beim Teetrinken beobachten: Oft wird das Getränk von einem hauchdünnen Film überzogen, der an der Innenwand der Tasse hängenbleibt, wenn man sie kippt. Die Ablagerung lässt sich nicht ohne weiteres abwaschen, man kann sie nur mechanisch entfernen, was sich in der Immunhistochemie verbietet.
Die Erfindung der BIOCHIPs bildete die Geschäftsgrundlage für das im Jahre 1987 gegründete Unternehmen EUROIMMUN (Stöcker, 3, 7 und 10). BIOCHIPs werden in der Autoimmundiagnostik eingesetzt. Die BIOCHIP-Technologie ermöglicht eine effiziente Produktion von Substraten für die indirekte Immunfluoreszenz. Sie eignet sich aber auch für die Diagnostik im pathohistochemischen Labor: Gewebeschnitte werden auf dünne Glasfolien aufgebracht und dann, zusammen mit dem Glas, herausgetrennt – im Ganzen oder in Fragmenten (BIOCHIPs). Die Fragmente werden auf BIOCHIP-Carrier geklebt.
Die heute in jedem pathohistochemischen Labor übliche chemische Aktivierung der Glasoberfläche geht auf eine weitere EUROIMMUN-Erfindung zurück (4): Die Gewebeschnitte werden über kovalente Brücken chemisch im Glas verankert, damit sie hundertfach fester anhaften – sie schwimmen bei den Inkubationen nicht mehr ab und die Strukturen bleiben besser erhalten. Für die Massenproduktion unterziehen wir heute Objektträger einer Plasmabehandlung und koppeln verschiedene Agentien kovalent an die Glasoberfläche.
 Zu den EUROIMMUN-Innovationen zählen die LED-bestückten kalibrierten Lichtquellen für die Fluoreszenzmikroskopie (9), mit denen das Unternehmen bereits tausende von Zeiss-Mikroskopen ausgerüstet und auf dem Weltmarkt verteilt hat. Sie haben großenteils die Quecksilberdampflampen abgelöst, weil sie billiger sind und 40.000 anstelle 100 Stunden durchhalten. Sie emittieren keine UV-Strahlung, entwickeln kaum, sind regelbar und kosten nur wenige Cent, nicht hundert Euro.
Zu den EUROIMMUN-Innovationen zählen die LED-bestückten kalibrierten Lichtquellen für die Fluoreszenzmikroskopie (9), mit denen das Unternehmen bereits tausende von Zeiss-Mikroskopen ausgerüstet und auf dem Weltmarkt verteilt hat. Sie haben großenteils die Quecksilberdampflampen abgelöst, weil sie billiger sind und 40.000 anstelle 100 Stunden durchhalten. Sie emittieren keine UV-Strahlung, entwickeln kaum, sind regelbar und kosten nur wenige Cent, nicht hundert Euro.
Bisher hat man für das automatische Mikroskop beim Fokussieren auf die Bildebene Bild für Bild von Fluoreszenz-Anregung auf Weißlicht umgeschaltet, um ein Ausbleichen des Fluorochroms zu verhindern (11, 14). Heute dauert das Scharfstellen nur den Bruchteil einer Sekunde und man kommt mit extrem wenig Licht aus, sodas man auf diese Finesse verzichten kann.
 Die computergestützte Immunfluoreszenz-Mikroskopie (CAIFM) ist ein anderer wichtiger Beitrag der Firma EUROIMMUN zur Diagnostik der Autoimmun- und Infektionskrankheiten: Die inkubierten Objektträger werden aus einem Magazin mit 50 oder 100 Zehn-Feld-Objektträgern nacheinander unter das Objektiv eines Mikroskops transportiert, die Bilder digital erfasst und durch eine Mustererkennungs-Software automatisch ausgewertet. Wahlweise kann der Untersucher das Mikroskop von seinem Schreibtisch aus interaktiv steuern und die Reaktionen am Bildschirm bewerten; er muss sich nicht zum Mikroskop begeben und es bedarf keiner Dunkelkammer mehr (12)
Die computergestützte Immunfluoreszenz-Mikroskopie (CAIFM) ist ein anderer wichtiger Beitrag der Firma EUROIMMUN zur Diagnostik der Autoimmun- und Infektionskrankheiten: Die inkubierten Objektträger werden aus einem Magazin mit 50 oder 100 Zehn-Feld-Objektträgern nacheinander unter das Objektiv eines Mikroskops transportiert, die Bilder digital erfasst und durch eine Mustererkennungs-Software automatisch ausgewertet. Wahlweise kann der Untersucher das Mikroskop von seinem Schreibtisch aus interaktiv steuern und die Reaktionen am Bildschirm bewerten; er muss sich nicht zum Mikroskop begeben und es bedarf keiner Dunkelkammer mehr (12)
Zur genauen Identifikation jedes einzelnen der zu untersuchenden Objektträger und zur Beschreibung vieler für die Analytik wichtiger Eigenschaften, wie Sorte, Charge, Haltbarkeit und weitere Eigenschaften, werden sie mit einem spezifischen Code versehen (15). Wo die Objektträger noch visuell ausgewertet werden, können die Ergebnisse durch ein System der Spracherkennung oder über Tastaturkürzel protokolliert werden (16).
In der Mikroskopier-Technik hat EUROIMMUN in jüngster Zeit enorme Fortschritte erzielt, die auch in der Pathologie genutzt werden können (17, 18, 25). Zusammen mit Prof. Thomas Martinetz von der Universität Lübeck und seinen Kollegen wurde das weltweit für die Autoimmundiagnostik beste automatische Mikroskop entwickelt, das einen rasanten Absatz findet.
BESCHREIBUNG DER EUROPATH-TECHNOLOGIE
EUROPath-Reagenzträger und EUROTide
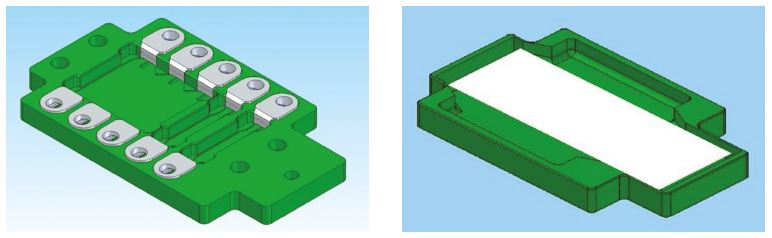 Im Vordergrund der EUROPath-Technologie stehen die EUROTide-Funktion und die BIOCHIP- basierte Handhabung der Gewebeschnitte für die Histochemie.
Im Vordergrund der EUROPath-Technologie stehen die EUROTide-Funktion und die BIOCHIP- basierte Handhabung der Gewebeschnitte für die Histochemie.
Der EUROPath-Reagenzträger weist einen flachen Boden auf. Durch das Auflegen eines Objektträgers (mit den Gewebeschnitten nach unten) entsteht eine Inkubationskammer, die nach außen hin weitgehend abgeschlossen ist und keine nennenswerte Verdunstung zulässt. Ständiges Kippen erzeugt permanent eine starke Konvektion (EUROTide: abwechselnd Ebbe und Flut). Dadurch werden die Reaktionen beschleunigt, die Signale verstärkt und die Inkubationszeit verkürzt. Der Reagenzienverbrauch sinkt auf ein Drittel (26)!
Die erzwungene Konvektion bei EUROTide beschert den Pathologen hervorragende Färbeergebnisse. Die Anordnung erfordert für die Inkubation keine umständliche Überschichtung der Objektträger mit Öl (Beim System der Firma Roche/Ventana will man dadurch erreichen, dass die Flüssigkeit nicht wegtrocknet, während man mit einem Luftstrahl Wellen auslöst, um etwas Bewegung in den Ansatz zu bekommen.).
Reagenzträger und Objektträger bleiben von Beginn der Inkubation an bis zum letzten Waschschritt vereinigt, der Inkubationsraum aber über Kanäle zugänglich. Zum Waschen wird zeitsparend Flüssigkeit im schnellen Wechsel zugegeben und abgesaugt. EUROPath-Reagenzträger sind temperaturstabil bis 110 ˚ C, resistent gegen Farbstoffe und Lösungsmittel und leicht zu reinigen.
In den EUROTide-Analyseablauf können sowohl BIOCHIP-Carrier als auch normale Standard-Objektträger mit konventionell angefertigten, beliebig großen Gewebeschnitten integriert werden
BIOCHIPs
Die BIOCHIP-Technologie bietet die Option der Fokussierung auf die diagnostisch relevanten Anteile der histologischen Proben: Gewebeschnitte werden auf Glasfolien aufgezogen und in diesem Verbund zu BIOCHIPs fragmentiert. Nur diejenigen Strukturen, die für die Untersuchung wichtig sind, werden aus den Gewebeschnitten herausgetrennt, und dann nach dem EUROTide-Prinzip inkubiert.
Es wird nur so viel Gewebe untersucht, wie erforderlich, man spart Platz und Reagenzien, und muss am Mikroskop nichts Überflüssiges begutachten – Ballast, mit dem nur Zeit verschwendet wird. Es können volle große Gewebeschnitte analysiert werden, aber auch beliebig kleine.
Heute verfügt EUROIMMUN über verschiedene Geräte zur optischen Erfassung der Gewebestrukturen (Scanner) sowie vollautomatische BIOCHIP-Fragmentier- und Bestückungsmaschinen aus eigener Entwicklung und eigenem Maschinenbau (29).
Steht von einer Biopsie nur wenig Gewebe zur Verfügung, kann sie zunächst gänzlich zu Gewebeschnitten aufgearbeitet werden, und man bringt sie auf Glasfolie auf. Danach wird das Gewebe zusammen mit der Glasfolie zu BIOCHIPs fragmentiert und auf Objektträger geklebt, und zwar so, dass man möglichst viele Einzelsubstrate mit den relevanten Strukturen erhält. Übrige beschichtete Glasfolien werden im Ganzen oder als BIOCHIPs in Tüten versiegelt oder in Blistern verpackt und kryokonserviert, portionsweise oder einzeln.
Um Gewebe-Arrays herzustellen, wird jede Gewebeprobe für sich allein geschnitten und zu BIOCHIPs verarbeitet, aus denen BIOCHIP-Mosaike zusammengesetzt werden. Aus kleinsten Biopsien erhält man ein Maximum an nutzbarem Substrat – ein Vorteil, wenn das Gewebe knapp ist. Enthält das Gewebe vereinzelte Nester mit den interessierenden Strukturen, können diese herausseziert und sich am Mikroskop auf das Wesentliche konzentriert werden.
Nur perfekte BIOCHIPs werden eingesetzt, und jedes Mosaik ist qualitativ vollkommen – ein großer Vorteil gegenüber herkömmlichen „Mortadella- Präparaten“, bei denen in Paraffinblöcken zusammengefasste Gewebestückchen mit dem Mikrotom geschnitten werden (Poschmann et al. 5, Stöcker et al. 6, Thorns et al. 8).
Anders als bei Paraffinschnitten gibt es für umfangreiche Gefrierschnitt-Arrays zu BIOCHIP-Mosaiken keine praktikable Alternative. Es ist zwar möglich, mehrere Organstückchen gemeinsam einzufrieren und als Paket im Kryotom zu Gefrierschnitten zu verarbeiten („Bunte Schnitte“). Mit diesem bekannten Verfahren lassen sich aber nur wenige Organe miteinander kombinieren. Auch verhalten sich die Gewebe beim Schneiden unterschiedlich – die Schneidetemperatur und die Schnittstärke müssen individuell eingestellt und die Schnitt-Ebene für jedes Organ individuell ausgerichtet werden, was in einem Verbund schwierig ist. Wird jedes Organ einzeln geschnitten und zu BIOCHIPs verarbeitet, ist außerdem die Ausbeute an brauchbaren Substraten maßgeblich höher. Man ist flexibel, wenn je nach Fragestellung oder Zeitpunkt Arrays mit unterschiedlicher Zusammensetzung gebraucht werden.
Mit der BIOCHIP-Technologie lassen sich auch sehr elegant gezielte Mikrosektionen aus Gewebeschnitten ausführen. BIOCHIPs mit einer Kantenlänge von 0,1 Millimeter wurden zum Beispiel für Polymerase-Chain-Reaktionen eingesetzt, um genetische Merkmale in bestimmten Zellgruppen zu bestimmen.
Nach Abschluss der Inkubationen werden sämtliche unterschiedlich gefärbten und behandelten BIOCHIPs, die von einem Patienten stammen, gemeinsamen auf einem Objektträger zusammengeführt und eingedeckt. Dadurch wird dem Pathologen die mikroskopische Auswertung signifikant erleichtert. Oder für Vergleichsanalysen werden BIOCHIP-Mosaiken mit Gewebeschnitten hundert verschiedener Tumoren nebeneinander zusammengestellt.
Zur eindeutigen Identifizierung jedes einzelnen BIOCHIPs kann man dem Trägerglas mit einem CO2-LASER 40 μm unterhalb der Oberfläche eine ausreichende Anzahl Codes eingravieren, sodass jeder BIOCHIP mindestens eine lösemittelresistente Kennung erhält, die das Mikroskop automatisch einlesen kann (Kryptocode, 21).
Die Gewebeschnitte werden auf kryptocodiertes Trägerglas aufgebracht, die relevanten Strukturen identifiziert, die Fragmentgröße definiert, entsprechende BIOCHIPs automatisch ausgestanzt und für die histochemische Analyse bereitgestellt.
Vollautomatische Färbeplattform EP-Dx
 Ein wesentliches Element der EUROPath-Technologie ist die vollautomatischen Färbe-Plattform „EUROPath Analyzer EP-Dx“. Sie basiert auf der EUROTide-Inkubationstechnik und zeichnet sich durch eine sichere Probenidentifikation, einen geringen Verbrauch an Reagenzien und brillante Färbungen aus. Sie ist vielseitig und wird neuen Schwung in die Diagnostik der Pathologie-Institute bringen (19, 20).
Ein wesentliches Element der EUROPath-Technologie ist die vollautomatischen Färbe-Plattform „EUROPath Analyzer EP-Dx“. Sie basiert auf der EUROTide-Inkubationstechnik und zeichnet sich durch eine sichere Probenidentifikation, einen geringen Verbrauch an Reagenzien und brillante Färbungen aus. Sie ist vielseitig und wird neuen Schwung in die Diagnostik der Pathologie-Institute bringen (19, 20).
Die Ingenieure der EUROIMMUN AG haben bei der Entwicklung der EP-Dx von einem großen Erfahrungsschatz profitiert: In der Vergangenheit haben sie über 70 verschiedene Analysegeräte und Produktionsmaschinen erdacht und aus der Taufe gehoben, darunter alle Vollautomaten für die BIOCHIP-Bestückung (10, 29), einen großen Random-Access-Automaten für Beadbasierte Immuntests (24), einen EUROTide- Vollautomaten für indirekte Immunfluoreszenz und Mikro-Immunblots, die Pipettiermaschine EUROLabLiquidHandler, daraus abgeleitet eine vollautomatische „Workstation“, die bald hundertfach in den weltgrößten Laboratorien zum Einsatz kommt, des Weiteren das System „MERGITE!“ zum schnellen und reproduzierbaren Waschen von Objektträgern.
Mehrere EP-Dx-Prototyp-Generationen wurden in der EUROIMMUN-Niederlassung Dassow auf „Herz und Nieren“ geprüft. Heute können bis zu 1.000 Gewebeproben auf einer Station nebeneinander untersucht werden, unter Anwendung bis zu 50 unterschiedlicher Färbe-Protokolle, und innerhalb weniger als drei Stunden pro Analysegang. Im Vergleich zur konventionellen Bearbeitung erzielt EP-Dx stärkere Reaktionen und verbraucht nur ein Drittel an (oft sehr teuren) Reagenzien. EP-Dx ist flexibel und offen, der Anwender kann für die Immunhistochemie eigene Antikörper einsetzen.
EP-Dx ist modular aufgebaut, auf Basis des EUROLabLiquidHandlers von EUROIMMUN. Der Arbeitsbereich ist komplett umschlossen, die Abluft wird gefiltert und überwacht, es riecht nicht nach organischen Lösemitteln, wie es in pathologischen Laboratorien üblich ist.
Die EUROTide-Funktion wird durch Wipp-Module bewirkt, auf denen die Reagenzträger liegen. Über ein digitales Lesesystem wird die Bestückung der einzelnen Wippen mit den Patientenproben überwacht. Gewaschen wird mit bis zu zehn verschiedenen Waschpuffern.
Über ein Schienensystem werden Reagenzien- Racks in einem fest definierten Raster zugeführt. Die Reagenzien tragen ID-Codes und werden beim Ladevorgang automatisch mit einem Scanner identifiziert. Das Beladen des Gerätes wird durch verschiedene optische Anzeigen unterstützt und verwechslungssicher gestaltet.
Ein 5-Nadel-Pipettieraggregat transferiert die Flüssigkeiten durch präzise Aspirations- und Dispensiervorgänge und legt auch Verdünnungen an. Jede Nadel wird separat angesteuert und jeder Kanal besitzt eine kapazitive Füllstandserkennung. Die Nadeln werden nach jedem Pipettier-Schritt von außen und innen effektiv gereinigt. Zum Waschen werden sowohl organische als auch wässrige Lösungsmittel verwendet, entflammbare Flüssigkeiten werden in einem aktiv belüfteten integrierten Sicherheitsschrank sicher aufbewahrt. Giftiger Abfall wird separat aufgefangen.
Der Färbeautomat wird mittels Touchscreen bedient und ist Random-Access-fähig. Der Anwender wird intuitiv und grafikunterstützt durch die Planung der Arbeitsliste, den Beladevorgang und den anschließenden Lauf geführt. Erforderliche Stammdaten und Assay-Programmierung werden in einer Datenbank. Die Software funktioniert unabhängig, kann aber mit anderer Labor- Software zur Übermittlung von Protokollen und Ergebnissen verbunden werden.
Rekombinante Kontrollsubstrate zur Funktionskontrolle der Reagenzien
In der Pathohistochemie muss bei jeder Inkubation durch humane Kontrollsubstrate nachgewiesen werden, dass die angewendeten Techniken korrekt ausgeführt wurden und die zur Färbung verwendeten Reagenzien funktioniert haben. Authentisches humanes Ausgangsmaterial steht aber nicht überall zur Verfügung und seine Verwendung wird teilweise auch als nicht legitim aufgefasst. Als Alternative werden in den molekularbiologischen Laboratorien der Firma EUROIMMUN die entsprechenden Antigene rekombinant hergestellt, für BIOCHIPs oder fertig bestückte Objektträger.
Bei EUROIMMUN wurden verschiedene Expressionssysteme etabliert, auf der Basis von Bäckerhefe, Insekten- und Säugerzellen. Gerade für die Bereitstellung authentischer Autoantigene ist die Nutzung humaner Expressionssysteme eine wichtige Voraussetzung. Von dieser Expertise machen wir zum Beispiel Gebrauch bei der Bestimmung von Autoantikörpern gegen Bestandteile des Gehirns – hier haben wir uns einen hervorragenden Ruf erarbeitet (23, 27, 28, 30, 31, 32).
EUROPathOffice
Die in den Serologie-Laboratorien etablierte EUROIMMUN-Organisations-Software (EUROLabOffice) wird auf die Bedingungen der Pathohistochemie zugeschnitten, um auch dort die Arbeit zu erleichtern und die Diagnostik zu standardisieren. In vielen konservativen Pathologie- Instituten besteht auf diesem Gebiet noch ein großer Nachholbedarf.
Histopattern (Pathohistochemical pattern evaluation)
Mikroskopische Bilder werden mehr und mehr von automatischen Mikroskopen erfasst, verarbeitet und archiviert. In Kooperation mit der Universität Lübeck entwickelt EUROIMMUN Verfahren der Mustererkennung, die es unter anderem ermöglichen, unterschiedlich gefärbte Serienschnitte virtuell zur Deckung zu bringen. Mit einer gewaltigen selbstlernenden dreidimensionalen Software soll die Mikroskopie in naher Zukunft für die Pathologen vollautomatisiert werden (33, 34).
Konkurrenz zu EUROPath und externer Stand der Technik
Der Marktführer Roche/Ventana bietet diverse Geräte für die Automatisierung der Pathologie an: „Symphony“ entparaffiniert und bietet automatische HE-Übersichtsfärbung und Spezialfärbungen. Außerdem werden Scanner und eine Software für das Pathologie-Labor angeboten (Tele-Pathologie).
Roche/Ventana bedient sich der sogenannten „Liquid-Coverslip-Technologie“: Der Inkubationsansatz wird mit Öl überschichtet, damit er nicht austrocknet, gezielte Luftstrahlen bewegen die Oberfläche und erzeugen auf diesem umständlichen Wege Konvektion.
Bei der von Leica genutzten Technologie wird durch das passgenaue Aufsetzen eines „Covertile“ ein Kapillarspalt als Reaktionsraum gebildet, um die Verdunstung der Reagenzien zu verhindern. Die Hitzebehandlung ist schwierig, die Verteilung der Färbelösungen ungleichmäßig, es gibt keine Konvektion.
Das „Xmatrx-System ULTRA“ und „Xmatrx ELITE“ von Biogenex sind vollautomatische Färbeautomaten für IHC, ISH, Fluoreszenz-insitu- Hybridisierung (FISH), In-situ-PCR und Spezialfärbungen auf Objektträgern. T
hermoFisher vermarktet Eindeckautomaten und Automaten zur Paraffinentfernung für die IHC. Der „Labvision Autostainer“ und der „Gemini“ führen IHC sowie Spezialfärbungen durch, parallel für eine Vielzahl von Objektträgern.
Der Automat „Omnis“ von Dako umfasst IHC und ISH auf einem Gerät und bietet Entparaffinierung und Gegenfärbung. Ein weiteres Gerät von Dako ist für die IHCausgelegt. Der „Hybridizer“ bewältigt Fluoreszenz- und Chromogen- in-situ-Hybridisierungen (FISH, CISH). „Artisan-Link“ ermöglicht vollautomatisch Spezialfärbungen. Aber nur fest definierte Abläufe sind möglich.
Von Leica Biosystems stammt der vollautomatische Färbeautomat „BOND-MAXe“ für IHC und ISH an. Des Weiteren werden Drucker für Objektträger und Kassetten Gewebeinfiltrationsautomaten, Einbettsysteme sowie verschiedene Mikrotome angeboten, zudem Mikroskope und Scanner, Software für die digitale Auswertung und die Dokumentation. Eine sogenannte „Workstation“ färbt automatisch und deckt ein.
Von Sakura Finetek kommt die sogenannte „SMART Automation“ – zum Gewebeschneiden, Entwässern, Färben und Eindecken. Mehrere Schnitte und Färbungen werden nebeneinander auf dem Bildschirm angezeigt.
Allen diesen technischen Ansätzen zur Automatisierung ist gemeinsam, dass im Gegensatz zu EUROPath Geräte, Reagenzien und Verbrauchsmaterial insgesamt teurer sind als bei den manuellen Verfahren. Der Ersparnis an Personalkosten stehen hohe Anschaffungs- und Betriebskosten entgegen.
Literatur
- Stöcker W. Vorrichtung zur Durchführung von Mikroanalysen. Patent EP 0018435 (1979). TITERPLANE-Technik.
- Stöcker W. Verfahren und Vorrichtungen für Untersuchungen an unbeweglich gemachtem biologischem Material. Patent Nr. 0 117 262 (1983). BIOCHIP-Technologie.
- Stöcker W. Rationelle Histochemie mit einer neuen Mikroanalysemethode. Acta histochem Suppl 31: 269-281 (1985). Erste Originalmitteilung der BIOCHIP-Technologie.
- Stöcker K, Stöcker W, Ritter-Frank Y, Scriba PC. Chemisch-aktivierte Glasobjektträger für Gefrierschnitte und ihre Anwendung in der Autoantikörperdiagnostik. Acta histochem (Jena) Suppl 31: 283-294 (1985).
- Poschmann A, Seitz C, Bein G, Böcker W, Geusendam G, Stöcker W. Rapid histochemical screening of monoclonal antibodies against tumor associated and other antigens using the „Titerplane-technique“. Immunobiol 170: 72-73 (1985).
- Stöcker W, Poschmann A, Seitz C, Heise R, Hornof B, Böcker W. Rationelles Screening von Fusionsüberständen zum histochemischen Nachweis monoklonaler Antikörper gegen Tumor-assoziierte und andere Antigene. Verh dtsch Ges Path 70: 393-395 (1986).
- Stöcker W. Die BIOCHIP-Technologie: Ein neuer Weg der Produktion Festphasegebundener Bioreagenzien für das medizinische und biologische Laboratorium. Dokumentation zur (erfolgreichen) Bewerbung um den vom Wirtschaftsminister des Landes Schleswig-Holstein überreichten Schmidt-Römhild-Technologiepreis 1989. Festveranstaltung am 10. November 1989 im Audienzsaal des Lübecker Rathauses.
- Thorns C, Noack F, Feller AC, Merz H, Stöcker W, Müller-Kunert E, Bernd H-W. Application of newly developed tissue-arrays to study EMMPRIN (CD147) ex-pression malignant non-Hodgkin lymphoma. Cancer Genomics & Proteomics 1: 45-52 (2004).
- Morrin M, Müller M, Wessel S, Rateike M, Stöcker W. Lichtquelle für ein Auflicht- Fluoreszenzmikroskop. Gebrauchsmuster DE 20 2004 010 121 (2004). LED für die Immunfluoreszenz.
- Stöcker W, Rateike M, Morrin M. Verfahren zur Herstellung Festphasen-gebundener Bioreagenzien. Patent DE 102004005100 (2004) und WO 2005/073693 (2005). Vollautomatisierung der BIOCHIP-Technologie.
- Stöcker W, Wessel S, Morrin M, Müller M. Konstante Lichtquelle für die Fluoreszenzmikroskopie. Deutsche Patentanmeldung DE 10 2006 027 518.7 (2006). LED für die Immunfluoreszenz.
- Stöcker W, Fauer H, Krause C, Barth E, Martinetz T. Verfahren zur Optimierung der automatischen Fluoreszenzerkennung in der Immundiagnostik. EP 2 030 001 (2007). Mustererkennung mikroskopischer Bilder.
- Stöcker W, Rateike M, Maltzahn B, Behring R. Analyseverfahren und Vorrichtung für biologische Reaktionen zwischen einer flüssigen und einer festen Phase. Patent EP 2 191 893 (2008). EUROtide.
- Morrin M. Vorrichtung und Verfahren zur automatischen Fokussierung für die Mikroskopie schwach leuchtender Substrate. Patent DE 10 2010 035 104.0 (2010) und WO 2012/025220 (2011).
- NN. Objektträger. Gebrauchsmuster DE 20 2011 005 278 (2011). Codierter Objektträger mit Informationen über Charge und sonstige Eigenschaften.
- Stöcker W, Ehling T. Vorrichtung und Verfahren zur Untersuchung einer biologischen Probe. Patentanmeldung DE 10 2011 011 795.4 (2011). Befund-Protokollierung beim Mikroskopieren durch Spracherkennung oder Tastatur-Kürzel. Dabei Korrelierung der Kreuztisch-Position mit der Befund-Adresse.
- Voigt J, Krause C, Rohwäder E, Saschenbrecker S, Hahn M, Danckwardt M, Feirer C, Ens K, Fechner K, Barth E, Martinetz T, Stöcker W. Automated indirect immunofluorescence evaluation of antinuclear autoantibodies on HEp-2 cells. Clin Dev Immunol, doi: 10.1155/2012/651058 [Epub] (2012).
- Hochstrate N, Krause C, Ens K, Voigt J. ANA and ANCA diagnostics with computeraided immunofluorescence microscopy (CAIFM). Zeitschrift für Rheumatologie 72: 24·(2013).
- Stöcker W, Rottmann N. Verfahren sowie Vorrichtung zur Inkubation von Patentientenproben. Patentanmeldung DE 10 2012 013 680 (2012) und WO 2014/009067 (2013). EUROTide für die Pathologie.
- Stöcker W, Rottmann N. Verfahren und Analysevorrichtung zur mikroskopischen Untersuchung eines Gewebeschnittes oder eines Zellausstriches. Patentanmeldung DE 10 2012 013 678 (2012) und WO 2014/009066 (2013). Flexible Anordnung von Gewebeschnitten, BIOCHIPs und Kontrollmaterial zur immunologischen bzw. histochemischen Untersuchung von Patientenproben.
- Rottmann N, Stöcker W, Koop N. Transparenter Objektträger mit Kennzeichnung. Patentanmeldung EP 2 896 458 (2014) und WO 2015/106774 (2014). Krypto-Codierung.
- Stöcker W. Verbesserte Vorrichtung und Verfahren für Reaktionen zwischen einer festen und einer flüssigen Phase. Patentanmeldung DE 10 2014 001 481 (2014) und WO 2015/62715 (2014). MERGITE! Ein Bidet zum Waschen für die Immunhistochemie.
- Jarius S, Scharf M, Begemann N, Stöcker W, Probst C, Serysheva II, Nagel S, Graus F, Psimaras D, Wildemann B, Komorowski L. Antibodies to the inositol 1,4,5-trisphosphate receptor type 1 (ITPR1) in cerebellar ataxia. J Neuroin-flammation 11: 206-2017 (2014).
- Stöcker W, Kowtun A, Maltzahn B, Koschinat L, Richter L. Verfahren und Vorrichtung zur Überführung von Flüssigkeiten. Patentanmeldung EP 2 959 971 (2014) und WO 2015/197176 (2015). Portionierte Reagenzien in Kapillaren.
- Krause C, Ens K, Fechner K, Voigt J, Fraune J, Rohwäder E, Hahn M, Danckwardt M, Feirer C, Barth E, Martinetz T, Stoecker W. EUROPattern-Suite technology for computer-aided immunofluorescence microscopy in autoantibody diagnostics. Lupus 24: 516-529 (2015).
- Kaffka C. Inkubationsrinne. Patentanmeldung WO2016/169576 (2015) und EP3085446 (2015). EUROPath-Reagenzträger.
- Scharf M, Miske R, Heidenreich F, Giess R, Landwehr P, Blöcker IM, Begemann N, Denno Y, Tiede S, Dähnrich C, Schlumberger W, Unger M, Teegen B, Stöcker W, Probst C, Komorowski L. Neuronal Na(+)/K(+) ATPase is an autoantibody target in paraneoplastic neurological syndrome. Neurology 84: 1673-1679 (2015).
- Lemcke S, Sokolowski S, Rieckhoff N, Buschtez M, Kaffka C, Winter-Keil A, Schaller C, Rottmann N, Sadik CD, Stöcker W, Zillikens D, Schmidt E. Automated direct immunofluorescence analyses of skin biopsies. J Cutan Pathol 43(3): 227-235 (2015).
- Eggert L. Traction arrangement. Patentanmeldung EP3106713 (2015) und WO2016/202448 (2016). Differentialgetriebe für den synchronen X-Y-Antrieb von Positionier-Tischen per Zahnriemen mit zwei beliebigen Antriebsmotoren.
- Miske R, Hahn S, Rosenkranz T, Müller M, Dettmann IM, Mindorf S, Denno Y, Brakopp S, Scharf M, Teegen B, Probst C, Melzer N, Meinck HM, Terborg C, Stöcker W, Komorowski L. Autoantibodies against glutamate receptor δ2 after allogenic stem cell transplantation. Neurol Neuroimmunol Neuroinflamm 3:e255 (2016).
- Miske R, Gross CC, Scharf M, Golombeck KS, Hartwig M, Bhatia U, Schulte-Mecklenbeck A, Bönte K, Strippel C, Schöls L, Synofzik M, Lohmann H, Dettmann IM, Deppe M, Mindorf S, Warnecke T, Denno Y, Teegen B, Probst C, Brakopp S, Wandinger KP, Wiendl H, Stöcker W, Meuth SG, Komorowski L, Melzer N. Neurochondrin is a neuronal target antigen in autoimmune cerebellar degeneration. Neurol Neuroimmunol Neuroinflamm 4(1):e307 (2016).
- Fraune J, Gerlach S, Renztsch K, Teegen B, Lederer S, Affeldt K, Fechner K, Danckwardt M, Voigt J, Probst C, Komorowski L, Stöcker W. Multiparametric serological testing in autoimmune encephalitis using computer-aided immunofluorescence microscopy (CAIFM). Autoimmun Rev 15(10):937-942 (2016).
- Feirer, C., Roznowicz, F., Paul, M., und Bernitt, E. Optical scanning arrangement and method. European patent application, filed 28.5.2017 (2017). Eine von mehreren Versionen des schnellen Mikroskop-Scannings.
- W. Stöcker. Histopattern. Angemeldete Marke, 12.5.2017 (2017)